从“肠脑轴”到中药新疗法的突破!Alzheimers Res Ther揭示肠道微生物如何影响阿尔茨海默症
来源:生物谷原创 2024-10-21 10:43
本研究揭示了肠道微生物群的改变对AD进展的重要影响,特别是在神经炎症和代谢调控方面的作用。研究发现,通过调控“肠脑轴”的代谢产物,可能为AD的治疗提供新的干预靶点。
 阿尔茨海默症(Alzheimer's Disease, AD)是一种主要影响老年人的神经退行性疾病,全球病例数量不断增加。近年来,肠道菌群失衡被认为与AD的发病机制密切相关,尤其是微生物代谢物对神经炎症的调控作用。然而,目前尚不清楚肠道微生物组和大脑中的神经炎症如何相互作用,或者这些相互作用如何影响大脑功能和认知。
阿尔茨海默症(Alzheimer's Disease, AD)是一种主要影响老年人的神经退行性疾病,全球病例数量不断增加。近年来,肠道菌群失衡被认为与AD的发病机制密切相关,尤其是微生物代谢物对神经炎症的调控作用。然而,目前尚不清楚肠道微生物组和大脑中的神经炎症如何相互作用,或者这些相互作用如何影响大脑功能和认知。
近日,中国中医科学院赵海誉研究团队在Alzheimers Res Ther发表了题为Intestinal endogenous metabolites affect neuroinflammation in 5×FAD mice by mediating "gut-brain" axis and the intervention with Chinese Medicine的研究论文,揭示了肠道微生物群的改变对AD进展的重要影响,特别是在神经炎症和代谢调控方面的作用。研究发现,通过调控“肠脑轴”的代谢产物,可能为AD的治疗提供新的干预靶点。

1. AD进展与肠道菌群的改变
认知缺陷表现
5×FAD小鼠(转基因小鼠,简称Tg-M)在认知功能评估中显示出明显的认知缺陷,尤其在Y迷宫和莫里斯水迷宫(Morris Water Maze, MWM)测试中,定位平台所需时间显著长于野生型小鼠(Wild-Type Mice, WT-M)。在MWM的探查试验中,Tg-M小鼠在目标象限的停留时间、移动距离和穿越平台的次数均低于WT-M小鼠。此外,尽管通常焦虑水平较高的动物在中心区域的探索时间较短,但Tg-M小鼠在该区域的停留时间是WT-M小鼠的2.4倍,且排泄的粪便量也显著增加。
雌性5×FAD小鼠(转基因小鼠,简称Tg-F)体重较低,表现出更高的死亡率和攻击性,其在认知任务中的表现显著低于同龄的Tg-M小鼠,尤其在MWM测试中潜伏期增加。
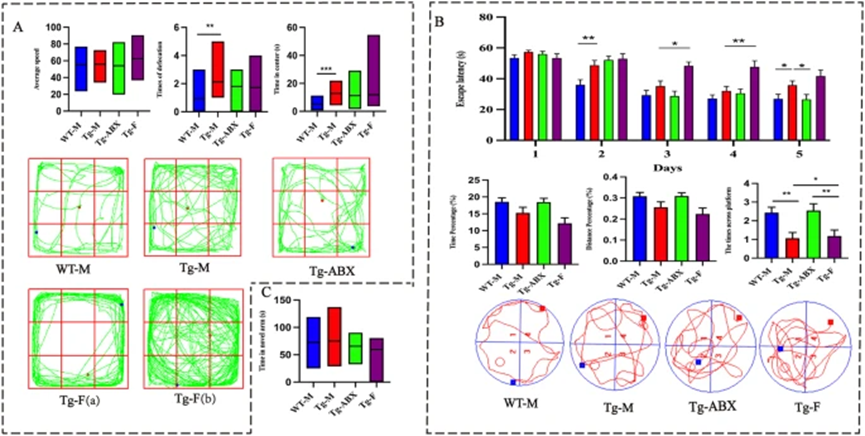
图1. AD小鼠认知缺陷和焦虑增加
CNS神经炎症
5×FAD转基因小鼠表现出加速的认知障碍、早期的淀粉样蛋白(Aβ)沉积以及突触退化,尤其在雄性小鼠的海马和皮层区域观察到快速的Aβ斑块积累。
ELISA检测显示,Tg-M小鼠大脑中三种Aβ(Aβ38、Aβ40、Aβ42)的浓度显著高于WT-M小鼠。免疫染色结果表明,5×FAD小鼠的大脑中活化的小胶质细胞和星形胶质细胞数量增加,尤其在Aβ斑块周围,这导致神经炎症和血脑屏障功能障碍。
此外,RT-PCR和Western blot分析发现主要组织相容性复合物II类(MHC-II)和促炎细胞因子(如IL-1α、TNF-α、MCP-1)的表达增加,抑制了小胶质细胞对Aβ的清除功能。与雄性小鼠相比,雌性Tg-F小鼠表现出更严重的神经炎症,其大脑中Aβ、IBA-1和GFAP水平显著提高。
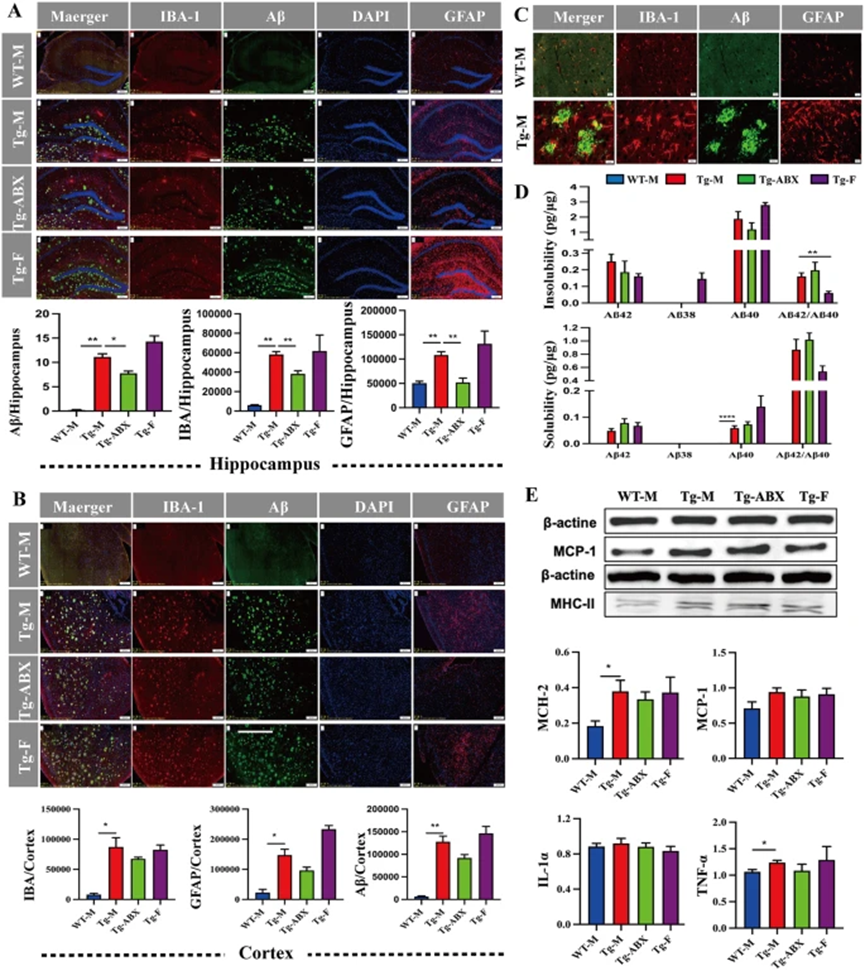
图2. Aβ升高会诱发神经炎症
外周免疫系统变化
5×FAD小鼠在外周免疫系统中表现出明显的功能失调,尤其是Th1(CD3+CD8−INFγ+)、Th2(CD3+CD8−IL4+)和Th17(CD3+CD8−IL17α+)细胞在转基因小鼠(Tg-M)脾脏中的比例显著高于野生型小鼠(WT-M),而调节性T细胞(Treg, CD4+CD25+Foxp3+)的频率则降低。
Th1细胞被认为在阿尔茨海默症(AD)中具有有害作用,其水平升高与小胶质细胞激活、炎症因子表达增加、认知功能受损和突触可塑性紊乱相关。研究发现,尽管Tg-M小鼠的Th1和Th2细胞均有所增加,但Th1/Th2比率下降,表明外周炎症加剧可能导致Th1细胞的升高和Th2细胞的过度分泌,进而引发Th1/Th2失衡。Treg细胞在AD中起到神经保护作用,其暂时耗竭会加速认知障碍并促进小胶质细胞清除Aβ沉积。
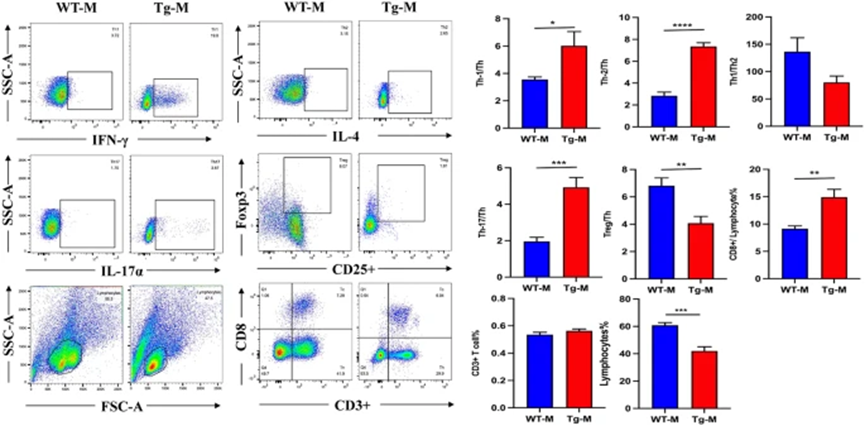
图3. AD小鼠脾脏中免疫细胞的水平
抗生素诱导的肠道微生物组扰动影响了认知和神经炎症
抗生素(ABX)诱导的肠道微生物组扰动显著影响了5×FAD小鼠(Tg-M)的认知功能和神经炎症。16S rRNA基因扩增子测序显示,Tg-M小鼠粪便中的α微生物多样性显著增加,而PLS-DA分析揭示其肠道微生物组成发生了明显变化。ABX治疗导致Tg-M小鼠的α多样性急剧下降,并打破了肠道菌群的结构稳态,同时Aβ聚集减少,表明抗生素治疗促进了小胶质细胞的清除功能。
此外,ABX还降低了脑内MHC II类和炎症细胞因子(如IL-1α、TNF-α和MCP-1)的表达,可能重置了小胶质细胞的吞噬功能。ABX显著改善了Tg-M小鼠的认知障碍和焦虑,表现在MWM任务中的学习记忆提升和开放场测试中粪便排泄减少。这些结果表明,“肠脑轴”能够实现双向信息传递,且Tg-M小鼠的功能通路在氨基酸、碳水化合物和能量代谢等方面较WT-M小鼠更为丰富。
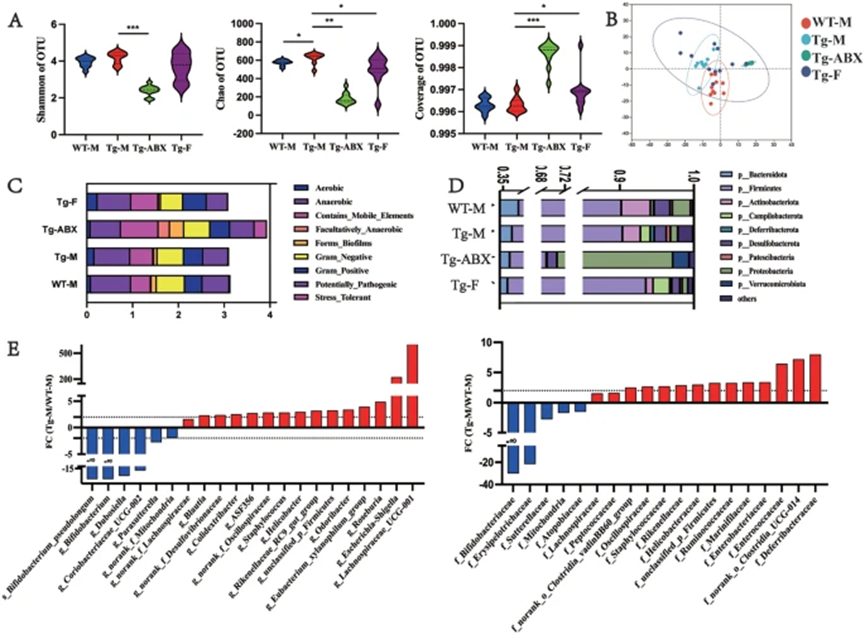
图4. 肠道微生物多样性的改变
2. 肠源性代谢物变化与氨基酸、碳水化合物和能量代谢的关系
短链脂肪酸(SCFAs)由肠道微生物发酵膳食纤维产生,调节能量代谢,并在微生物-肠-脑相互作用中发挥重要作用。
在Tg-M小鼠的粪便中,SCFAs产生菌的丰度显著变化,具体表现为有益菌如Erysipelotrichaceae和Bifidobacteriaceae的减少,以及Lachnospiraceae的增加。此外,Tg-M小鼠粪便中的哌啶酸(PA)水平下降,异丁酸(IBA)水平上升。纵向研究显示,Tg-M小鼠在9至11个月期间的粪便SCFAs水平快速增加,表明肠道微生物群的动态变化与SCFAs生成密切相关。
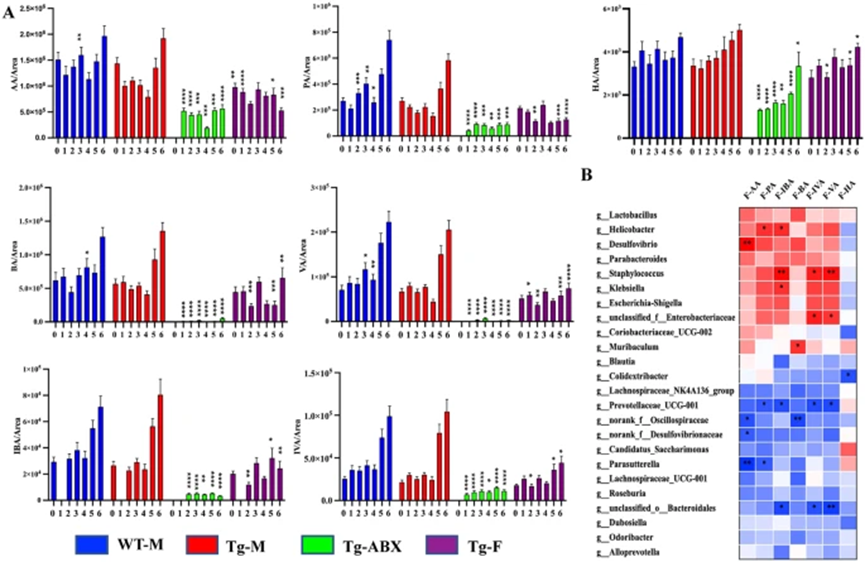
图5. AD小鼠粪便中 SCFA 的改变
3. 肠源性代谢物是肠脑轴的沟通中介
肠源性代谢物通过血液进入全身,影响大脑功能并在阿尔茨海默症等神经疾病中影响认知。使用气相色谱-串联质谱(GC-QQQ-MS)和液相色谱-串联质谱(LC-QQQ-MS)研究发现,5×FAD小鼠(Tg-M)的大脑中短链脂肪酸(SCFAs)水平与小胶质细胞激活呈正相关,且Tg-M小鼠的粪便、血清和脑组织中IBA水平高于野生型小鼠(WT-M)。
外周血中丙氨酸、色氨酸、牛磺酸等氨基酸水平显著增加,同时大脑中的丙氨酸、甲硫氨酸、GABA等浓度也显著升高。Tg-M小鼠表现出葡萄糖代谢障碍和线粒体功能障碍,PICRUSt分析预测其能量代谢出现障碍。在Tg-M小鼠中,丙酮酸水平显著升高,而柠檬酸和琥珀酸水平则显著降低,且外周和大脑中的代谢物变化趋势一致。这些结果表明,缺氧加重的线粒体功能障碍与Tg-M小鼠中脂质过氧化增加的现象相关。
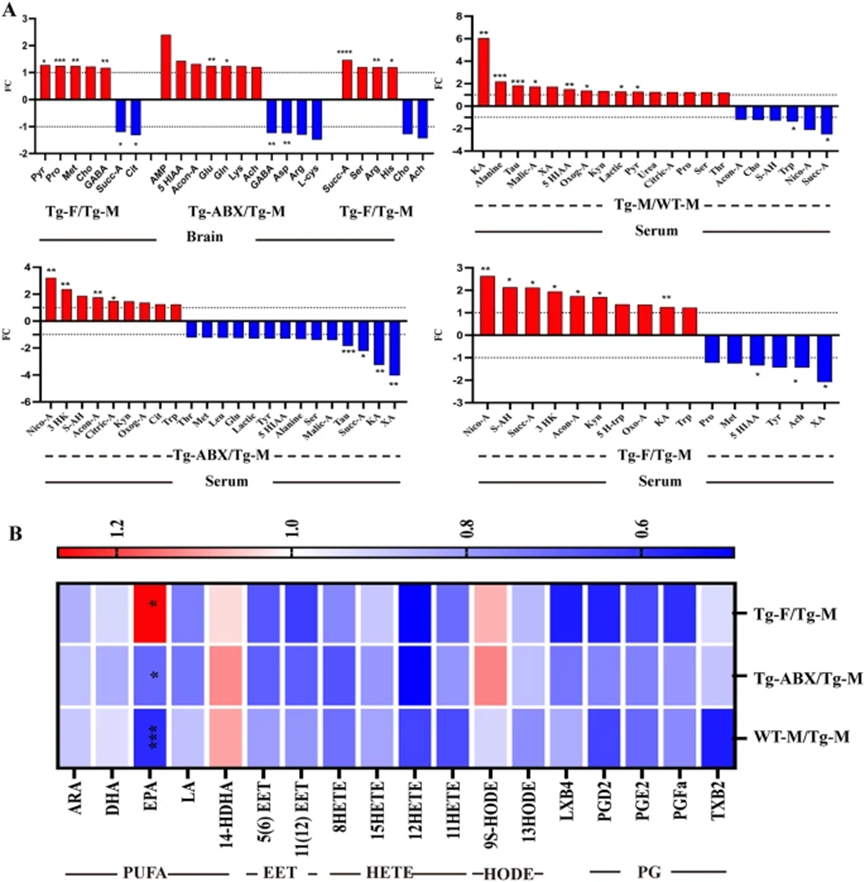
图6. AD小鼠外周血和脑内源性代谢物的变化
4. 黄连解毒汤(HLJDD)通过调节肠道微生物代谢缓解AD小鼠的神经炎症
在对5个月大的雄性5×FAD小鼠进行六个月的HLJDD治疗后,研究发现其认知障碍和焦虑显著改善,表现为莫里斯水迷宫(MWM)测试中的学习和记忆能力提升,以及开放场测试中排便量减少。
HLJDD通过降低由Aβ和免疫细胞相互作用引发的炎症因子(如IL-1α和INF-γ)分泌,缓解了神经炎症。分析显示,HLJDD重塑了小鼠的肠道微生物结构,增加了SCFA产生菌的丰度,并降低了SCFAs的整体水平。HLJDD组的SCFAs水平与某些细菌群体呈负相关,而与其他细菌群体呈正相关。
此外,HLJDD还提高了粪便中胆碱水平,降低了色氨酸、GABA、牛磺酸和亮氨酸的含量,并通过调节外周免疫细胞(降低Th1和Th2细胞,增加Treg细胞)进一步改善了5×FAD小鼠的神经炎症和认知功能。
总体而言,本研究探讨了肠道微生物群的改变如何影响阿尔茨海默症(AD)的进展,结果显示5×FAD小鼠在认知测试中表现出明显的缺陷,伴随脑中Aβ沉积和神经炎症的加重。
研究发现,短链脂肪酸(SCFAs)产生菌显著减少,而异丁酸等代谢物浓度升高,这些变化与神经炎症和认知功能下降密切相关。同时,外周免疫系统中的Th1细胞比例增加,调节性T细胞(Treg)比例减少,导致免疫失衡。
这些结果强调了“肠脑轴”在AD进展中的关键作用,表明通过调节肠道微生物及其代谢产物可能为AD的干预提供新的治疗靶点,为未来研究与临床应用奠定了基础。(生物谷Bioon.com)
参考文献:
Gu X, Fan M, Zhou Y, et al. Intestinal endogenous metabolites affect neuroinflammation in 5×FAD mice by mediating "gut-brain" axis and the intervention with Chinese Medicine. Alzheimers Res Ther. 2024;16(1):222. Published 2024 Oct 14. doi:10.1186/s13195-024-01587-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


